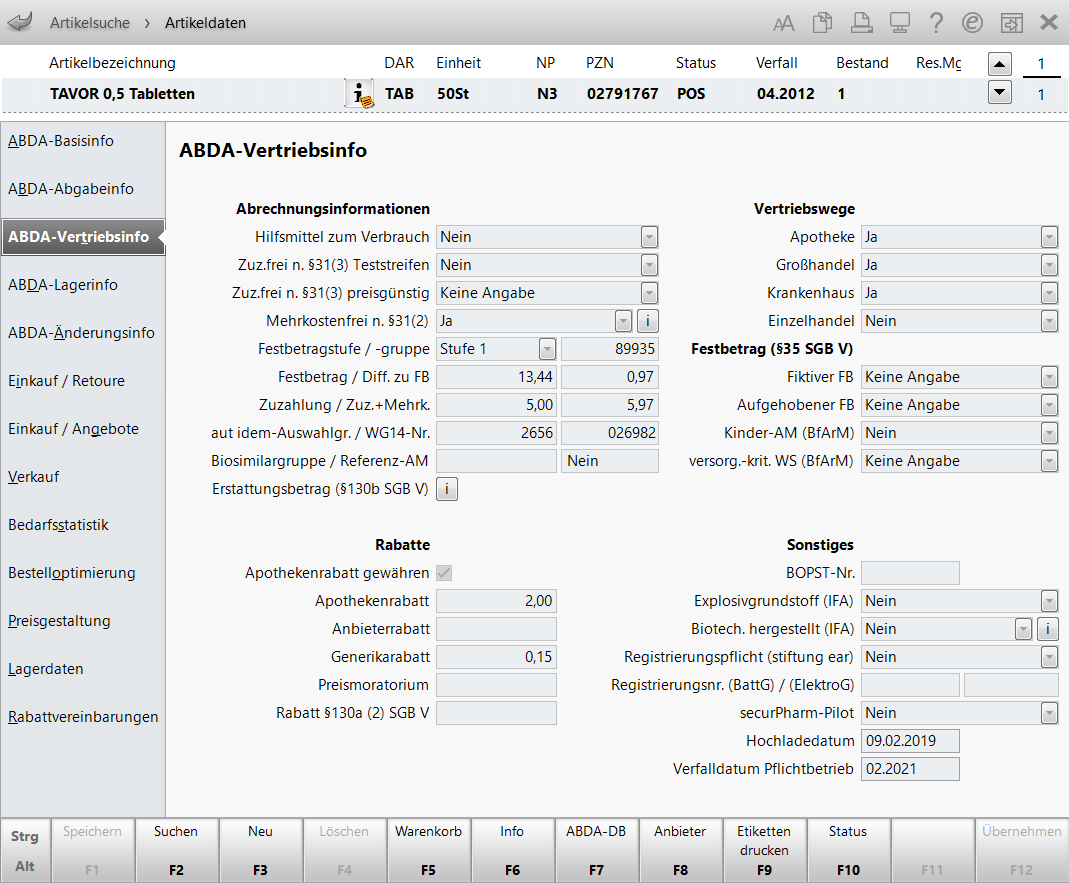
ABDA-Vertriebsinfo
Die Eingabefelder sind nur bei selbst angelegten Artikeln und vorerfassten ABDA-Artikeln eingabefähig.
Über die Auswahlleiste oben im Fenster können Sie zwischen den Artikeln der letzten Trefferliste wechseln. Die Daten des gewählten Artikels werden auf der Seite unten im Fenster angezeigt.
Von links nach rechts zeigt die Auswahlleiste folgende Informationen zum aktuellen Artikel:
-
Icon 'Vertriebsinformation'

Außer Vertrieb 
Rückruf 
zurückgezogen 
Nachfolgeartikel 
Vorgängerartikel 
Außer Vertrieb, gelöscht 
Rückruf', gelöscht 
zurückgezogen', gelöscht 
gelöschter (selbst angelegter) Artikel 
Außer Vertrieb' mit Nachfolger 
Außer Vertrieb' mit Vorgänger 
Außer Vertrieb', gelöscht mit Nachfolger 
Außer Vertrieb', gelöscht mit Vorgänger 
Rückruf' mit Nachfolger 
Rückruf' mit Vorgänger 
Rückruf', gelöscht mit Nachfolger 
Rückruf', gelöscht mit Vorgänger 
zurückgezogen' mit Nachfolger 
zurückgezogen' mit Vorgänger 
zurückgezogen', gelöscht mit Nachfolger 
zurückgezogen', gelöscht mit Vorgänger 
selbst angelegter Artikel mit Nachfolger 
selbst angelegter Artikel mit Vorgänger 
gelöschter (selbst angelegter Artikel mit Nachfolger 
gelöschter (selbst angelegter) Artikel mit Vorgänger. Mit Klick auf die (kombinierten) Vorgänger-/Nachfolgerbuttons öffnet sich die 'Artikelsuche mit Nachfolge- und Vorgängerartikel' 
Sonderartikel (Ärztemuster, Musterartikel) 
Rote-Hand-Brief (Anzeige nur während des Gültigkeitszeitraums bzw. bis zu 6 Monate nach Erscheinen) 
Rote-Hand-Brief, dessen Gültigkeitszeitraum abgelaufen ist bzw. der älter als 6 Monate ist 
Informationsbrief (Anzeige nur während des Gültigkeitszeitraums bzw. bis zu 6 Monate nach Erscheinen) 
Informationsbrief, dessen Gültigkeitszeitraum abgelaufen ist bzw. der älter als 6 Monate ist 
Schulungsmaterial Priorität der Anzeige:
-
Vertriebsfähigkeitsstatus
-
Rote-Hand-Brief
-
Informationsbrief
-
Schulungsmaterial
-
Vorgänger/Nachfolger
-
selbst angelegter Artikel
-
- Artikelbezeichnung und weitere Artikeldetails
-
Symbol 'Artikelinformation' ggf. kombiniert mit sonstigen Informationen

aktuelle Info (nicht länger als 6 Monate zurückliegend) 
eigene Info 
aktuelle und eigene Info 
aktuelle, eigene und sonstige Info 
eigene und sonstige Info 
sonstige Info: Teedrogen-, Produkt- und Anbieter-Informationen
- DAR - Darreichungsform-Kennzeichen.
- Einheit - Packungsgrößenangabe in Menge und Einheit.
-
NP - Normpackungsgröße. Folgende Angaben sind neben N1, N2 u. N3 möglich:
nb nicht betroffen - der Artikel ist nicht von der Packungsgrößenverordnung betroffen. nt nicht therapiegerecht - die Packungsgröße ist größer als die größte vorgegebene Messzahl. - PZN - Pharmazentralnummer.
- Status: Aktueller Lagerstatus des Artikels.
- Verfall: Zeigt das nächste Verfalldatum.
- Bestand: Aktueller Bestand des Artikels, berechnet über alle Bestände.
- Nachl.: Für offene Nachlieferungen benötigte Menge.
- Res.Mg: In offenen (nicht abgeschlossenen) Verkäufen reservierte Menge. Mehr dazu im Thema 'Temporäre Reservierung von Packungen in offenen Verkäufen'.
In diesem Bereich werden folgende Informationen angezeigt:
- Hilfsmittel zum Verbrauch:
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja', 'Ja/Ausnahme'. - Zuz.frei n. §31(3) Teststreifen:
Kennzeichnet, ob der Artikel gemäß §31(3) SGB V als Blut- und Harnteststreifen für GKV-Versicherte bei einer Verordnung von der Zuzahlung befreit ist.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Zuz.frei n. §31(3) preisgünstig:
Kennzeichnet, ob der Artikel gemäß § 31 (3) SGB V als preisgünstiger Festbetragsartikel eingestuft ist und damit der GKV-Versicherte bei einer Verordnung keine Zuzahlung zu leisten hat.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Mehrkostenfrei nach §31(2):
Kennzeichnet, ob es sich um einen Artikel handelt, für den nach §31(2) SGB V ggf. die GKV den Mehrkostenanteil übernimmt.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
Klicken Sie auf das , um die Kostenträger einzusehen, die für diesen Artikel die Mehrkosten übernehmen (Mehrkostenverzicht).
, um die Kostenträger einzusehen, die für diesen Artikel die Mehrkosten übernehmen (Mehrkostenverzicht). - Festbetragsstufe/-gruppe:
Der Eintrag im ersten Feld gibt die Festbetragsstufe des Artikels wieder. Mögliche Angaben: - Stufe 1: Arzneimittel mit gleichen Wirkstoffen und gleicher Wirkstoffstärke.
- Stufe 2: Arzneimittel mit vergleichbaren Wirkstoffen.
- Stufe 3: Arzneimittel mit vergleichbarer Wirkung (gleiche Indikation).
- Festbetrag / Diff. zu FB:
Das erste Feld zeigt den Festbetrag, das zweite die berechnete Preisdifferenz dieses Artikels zum Festbetrag. - Zuzahlung / Zuz. + Mehrk.:
Das erste Feld zeigt die berechnete Zuzahlung für diesen Artikel. Handelt es sich um einen A+V-Artikel, wird 'A+V' angezeigt.
Das zweite Feld zeigt die Summe aus Zuzahlung und Mehrkosten. - aut idem-Auswahlgr.:
Zeigt die aut idem-Auswahlgruppe des Artikels.Der G-BA gruppiert Artikel, die gemäß § 129 SGB V ausgetauscht werden können (aut idem-Regelung). Diese Gruppierung wird von ABDATA mit einem eindeutigen Schlüssel versehen; dieser wird als aut idem-Auswahlgruppe angezeigt.
-
Biosimilargruppe / Referenz-AM:
Biosimilargruppe - Alle Artikel mit der gleichen Biosimilargruppe gehören zur gleichen Position der Anlage VIIa der Arzneimittel-Richtlinie, da sie auf ein gemeinsames Referenzarzneimittel zugelassen sind bzw. selbst dieses Referenzarzneimittel sind. Diese Artikel unterliegen den Regelungen des § 40b der Arzneimittel-Richtlinie.
Referenz-AM - Kennzeichen, ob ein Artikel gemäß § 40b der Arzneimittel-Richtlinie in der zugehörigen Anlage VIIa als Referenzarzneimittel gekennzeichnet ist.
-
 Erstattungsbetrag (§130b SGB V)
Erstattungsbetrag (§130b SGB V)
Klicken Sie auf das
 , um das Fenster Erstattungsbetrag nach §130b SGB V zu öffnen. Sofern vereinbart und/oder festgesetzt werden hier Informationen zum Erstattungsbetrag nach §130b SGB V angezeigt.
, um das Fenster Erstattungsbetrag nach §130b SGB V zu öffnen. Sofern vereinbart und/oder festgesetzt werden hier Informationen zum Erstattungsbetrag nach §130b SGB V angezeigt. 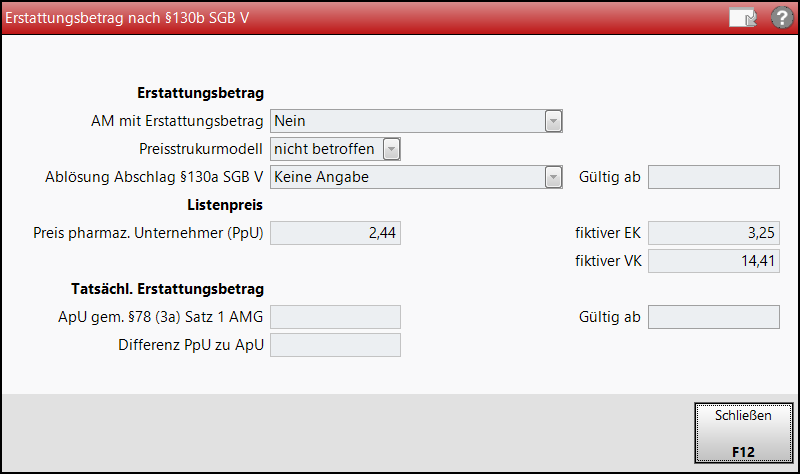
Erstattungsbetrag
-
AM mit Erstattungsbetrag:
Kennzeichen, ob für den Artikel nach § 130b SGB V ein Erstattungsbetrag gilt bzw. ungeachtet des Wegfalls des Unterlagenschutzes fortgilt oder ob es sich beim Artikel um ein Reserveantibiotikum handelt.
-
Preisstrukturmodell:
Für Arzneimittel, deren Erstattungsbetrag aufgrund von § 130b Abs. 8a SGB V als höchstens zulässiger Abgabepreis ungeachtet des Wegfalls des Unterlagenschutzes fortgilt, wird hier eine Information zum Preisstrukturmodell angegeben.
-
Ablösung Abschlag §130a SGB V:
'Ja, Ablösung Abschlag §130a (1/8)' kennzeichnet Artikel, deren Erstattungsbetrag nach §130a Abs. 1 Satz 4 in Verbindung mit §130a Abs. 8 Satz 6 SGB V den Abschlag nach § 130a Abs. 1 SGB V ablöst. Dieser Abschlag ist somit in den Erstattungsbetrag (ApU gem. §78 (3a) Satz 1 AMG) eingerechnet, das Feld Rabattwert zu Lasten des Anbieters (Anbieterrabatt) bleibt daher leer.
Gültig ab:
Datum, ab dem die Ablösung des Abschlags §130a SGB V gilt.
Listenpreis
-
Preis pharmaz. Unternehmer (PpU):
Preis des pharmazeutischen Unternehmers in € (ohne MwSt.). Die Angabe ist obligatorisch, wenn für einen Artikel ein Erstattungsbetrag nach §130b SGB V vereinbart oder festgesetzt wurde. Es handelt sich hierbei um den nach §78 (3) AMG zu meldenden Preis.
-
fiktiver EK:
Apothekeneinkaufspreis auf Basis des Preises des pharmazeutischen Unternehmers in € (ohne MwSt.) bzw. fiktiver Listen-Apothekeneinkaufspreis.
Die Preisangabe ist auch bei vorhandenem Preis des pharmazeutischen Unternehmers optional.
-
fiktiver VK:
Apothekenverkaufspreis auf Basis des Preises des pharmazeutischen Unternehmers in € (inkl. MwSt.) bzw. fiktiver Listen-Apothekenverkaufspreis.
Die Preisangabe ist auch bei vorhandenem Preis des pharmazeutischen Unternehmers optional.
Tatsächl. Erstattungsbetrag
-
ApU gem. §78 (3a) Satz 1 AMG:
Abgabepreis des pharmazeutischen Unternehmers gemäß §78 (3a) Satz 1 AMG in € (ohne MwSt.). In Verhandlung zwischen GKV und PU festgesetzter Erstattungsbetrag nach §130b SGB V, der durch weitere Preissenkungen oder Ablösung anderer Rabatte nicht verändert ist. Angegeben ist der unveränderte nach §130b SGB V vereinbarte oder festgesetzte Erstattungsbetrag.
Gültig ab:
Datum, ab dem der Abgabepreis des pharmazeutischen Unternehmers nach §78 Abs. 3a Satz 1 AMG gilt.
-
Differenz PpU zu ApU:
Differenz zwischen dem Preis des pharmazeutischen Unternehmers (PpU) und dem Abgabepreis gemäß §78 (3a) Satz 1 AMG (ApU gem. §78 (3a) Satz 1 AMG) in €. Abgelegt wird das Resultat der Berechnung Preis pharmaz. Unternehmer (PpU) minus ApU gem. §78 (3a) Satz 1 AMG, sofern beide definiert sind. Negative Werte sind möglich.
Vertraulichk. Erstattungsbetrag
-
Best. n. § 130b (1c) SGB V:
Kennzeichen, ob für das Arzneimittel eine Bestimmung nach§ 130b (1c) SGB V zutrifft. Mit diesem Kennzeichen wird die Information abgebildet, ob für das Arzneimittel eine Bestimmung nach § 130b Abs. 1c SGB V erfolgt ist, d.h. ob eine Datenübermittlung abweichend nach § 131 Absatz 4 Satz 3 Nummer 2a SGB V erfolgt (Vertraulichkeit des Erstattungsbetrages).
Wertebereich: Keine Angabe, Nein, Ja
-
Gültig ab: Datum, ab dem der Abgabepreis des pharmazeutischen Unternehmers nach § 78 Abs. 3a Satz 1 AMG mit Bestimmung nach § 130b Abs. 1c SGB V gilt.
-
Zuz. n. § 61 (1) SGB V:
Für Arzneimittel, für welche eine Bestimmung nach § 130b (1c) SGB v zutrifft (Best. n. § 130b (1c) SGB V), ist die auf Grundlage des vertraulichen Erstattungsbetrags berechnete Höhe der Zuzahlung nach § 61 Satz 1 SGB V angegeben. Diese Zuzahlung ist anstelle der auf Basis des Abgabepreises errechneten Zuzahlung heranzuziehen.
-
Im zweiten Feld wird die Nummer der Festbetragsgruppe angezeigt.
In diesem Bereich werden folgende Informationen angezeigt:
- Apothekenrabatt gewähren
 :
:
Ist das Kontrollkästchen aktiviert , handelt es sich um einen Artikel, für den ein Rabatt zu Lasten der Apotheke gemäß §130 SGB V existiert.
, handelt es sich um einen Artikel, für den ein Rabatt zu Lasten der Apotheke gemäß §130 SGB V existiert. - Apothekenrabatt:
Zeigt den berechneten Rabattwert zu Lasten der Apotheke in Euro. - Anbieterrabatt:
Zeigt den Rabattwert in Euro zu Lasten des Anbieters. Dieser Rabattwert ergibt sich aufgrund des § 130a (1) / (1a) SGB V oder § 130b (1c) SGB V, wonach ein Anbieter für bestimmte Fertigarzneimittelpackungen gegenüber der GKV einen Rabatt zu gewähren hat. Bei von § 130b (1c) SGB V betroffenen PZN berechnet sich der Abschlag nicht wie üblich aus dem ApU, sondern aus dem vertraulichen, nicht öffentlichen Erstattungsbetrag, und enthält als weitere Komponente noch einen Sonderabschlag von 9%. - Generikarabatt:
Zeigt den Rabattwert in Euro zu Lasten des Anbieters für ein Generikum.
Dieser Rabattwert ergibt sich aufgrund des §130a(3b) SGB V, wonach ein Anbieter für patentfreie, wirkstoffgleiche Fertigarzneimittelpackungen (= 'Generika') gegenüber der GKV einen Rabatt zu gewähren hat. Die tatsächliche Rabatthöhe wird nach einem komplexen Rechenverfahren ermittelt und kann auch den Wert '0,00' annehmen. - Preismoratorium:
Zeigt den Rabattwert in Euro zu Lasten des Anbieters aufgrund des Preismoratoriums. Ein Preismoratorium ist eine zeitlich begrenzte Preisbindung. Sie dient dazu, Preiserhöhungen auszuschließen bzw. zeitlich aufzuschieben.
Dieser Rabattwert ergibt sich aufgrund des §130a(3a) SGB V, wonach ein Anbieter für bestimmte Fertigarzneimittelpackungen den Betrag einer Preiserhöhung zwischen dem 01.11.2005 und dem 31.03.2008 gegenüber der GKV als Rabatt zu gewähren hat. Die tatsächliche Rabatthöhe wird nach einem komplexen Rechenverfahren ermittelt und kann aufgrund von Ausnahmeregelungen auch den Wert '0,00' annehmen. -
Rabatt § 130a (2) SGB V
Der Abschlag betrifft Impfstoffe für Schutzimpfungen nach § 20d (1) SGB V und ist bei der Importpreisabstandsprüfung zu berücksichtigen. Die Angabe erfolgt in Cent.
In diesem Bereich werden folgende Informationen angezeigt:
- Apotheke:
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Großhandel:
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Krankenhaus:
Zeigt das Kennzeichen, ob für den Artikel der Vertriebsweg Krankenhausapotheke (im Sinne von KVA) existiert. Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Einzelhandel:
Zeigt das Kennzeichen, ob für den Artikel der Vertriebsweg (sonstiger) Einzelhandel existiert. Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
-
Fiktiver FB:
Kennzeichen, ob es sich beim Artikel um ein Arzneimittel mit altersgerechter Darreichungsform oder Wirkstärke für Kinder handelt und ob für dieses gemäß § 35 Abs. 1a SGB V ein fiktiv festgesetzter Festbetrag gilt.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
-
Aufgehobener FB:
Kennzeichen, ob es sich beim Artikel um ein Arzneimittel handelt, für welches gemäß § 35 Abs. 5 Satz 8 SGB V der Festbetrag aufgehoben wurde.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
-
Kinder-AM (BfArM)
Kennzeichen, ob es sich beim Artikel um ein Arzneimittel zur Behandlung von Kindern handelt, welches gemäß § 35 Abs. 5a SGB V auf der Liste des Bundesinstitutes für Arzneimittel und Medizinprodukte (BfArM) aufgeführt ist. Die Liste nennt Arzneimittel, die aufgrund der zugelassenen Darreichungsformen und Wirkstärken zur Behandlung von Kindern notwendig sind.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja, FB aufgehoben', 'Ja, bisher kein FB'.
-
versorg.-krit. WS (BfArM)
Kennzeichen, ob es sich beim Artikel um ein Arzneimittel mit versorgungskritischem Wirkstoff handelt, welches gemäß § 35 Abs. 5b SGB V auf der Liste des Bundesinstitutes für Arzneimittel und Medizinprodukte (BfArM) aufgeführt ist.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja, FB angehoben', 'Ja, bisher kein FB'.
- BOPST-Nr.
Hierbei handelt es sich um ein 8-stelliges nummerisches Kennzeichen (vom BfArM „Pharmazentralnummer“ genannt) der Bundesopiumstelle für den Außenhandel mit Betäubungsmitteln.
- Explosivgrundstoff (IFA)
Kennzeichnung hinsichtlich eines Explosivgrundstoffs aus den von IFA gelieferten Daten
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
Der Wert ja bedeutet, der Artikel enthält Stoffe gemäß der Anlagen zu Artikel 2 der VO 98/2013.Die Verordnung (EU) Nr. 98/2013 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe legt einheitliche Vorschriften für Stoffe fest, die für die unrechtmäßige Herstellung von Explosivstoffen missbraucht werden könnten. Die Verordnung zielt außerdem darauf ab, die Verfügbarkeit dieser Stoffe für die Allgemeinheit einzuschränken und die angemessene Meldung über verdächtige Transaktionen in der gesamten Lieferkette sicherzustellen.
Betroffene Stoffe können beispielsweise Chemikalien, Biozide, Medizinprodukte, Kosmetika, Pflanzenschutzmittel oder sonstige Artikel des Nebensortimentes sein. Arzneimittel sind von diesem Kennzeichen nicht betroffen.
Explosivgrundstoffe sind in Artikeltrefferlisten mit dem -Symbol gekennzeichnet.
-Symbol gekennzeichnet. - Biotech. hergestellt (IFA)
Kennzeichnung hinsichtlich einer biotechnologischen Herstellung aus den von IFA gelieferten Daten
Mit Auswahl des
 Info-Buttons öffnet sich das Fenster zur Anzeige des vollständigen Kennzeichens:
Info-Buttons öffnet sich das Fenster zur Anzeige des vollständigen Kennzeichens: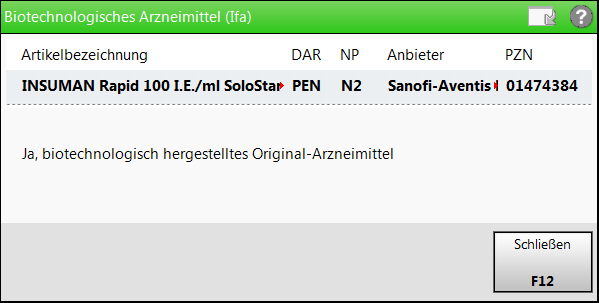
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja, biotechnologisch hergestelltes Original-Arzneimittel', 'Ja, Biosimilar', 'Ja, biotechnologisch hergestelltes Arzneimittel, bezugnehmend zugelassen, Ausgangsstoffe und Herstellungsprozess identisch'.
- Ja, Biosimilar
Biosimilars sind biotechnologisch hergestellte Arzneimittel, die den Originalpräparaten ähneln, aber mit diesen nicht identisch sind.
- Ja, biotechnologisch hergestelltes Arzneimittel, bezugnehmend zugelassen, Ausgangsstoffe und Herstellungsprozess identisch
Der Wert kennzeichnet biotechnologisch hergestellte Arzneimittel, die auf das jeweilige Referenzarzneimittel bezugnehmend zugelassen sind und sich in Ausgangsstoffen und Herstellungsprozess nicht unterscheiden. Aus der Kennzeichnung geht nicht hervor, auf welches Referenzarzneimittel die Zulassung bezugnehmend ist.
- Ja, biotechnologisch hergestelltes Arzneimittel, das zu einem weiteren biotechnologisch hergestellten Arzneimittel in Ausgangsstoffen und Herstellungsprozess identisch ist
Der Wert kennzeichnet biotechnologisch hergestellte Arzneimittel, die zu einem weiteren biotechnologisch hergestellten Arzneimittel in Ausgangsstoffen und Herstellungsprozess identisch ist und sich in Ausgangsstoffen und Herstellungsprozess nicht unterscheiden. Aus der Kennzeichnung geht nicht hervor welche weiteren biotechnologisch hergestellten Arzneimittel zugelassen sind.
Unplausible Konstellationen zwischen diesem IFA-Kennzeichen und dem bestehenden Kennzeichen des ABDA-Artikelstamms (Seite 'ABDA-Abgabeinfo', Feld Biotechnologisch hergestellt) können auftreten und sind den unterschiedlichen Datenquellen geschuldet.
- Ja, Biosimilar
-
Registrierungspflicht (stiftung ear)
Die stiftung ear (Stiftung elektro-altgeräte register) ist zuständig für die Registrierungspflichten der Anbieter von Batterien (nach BattG) und von Elektro- und Elektronikgeräten (nach ElektroG). Ohne vorherige Registrierung bei der stiftung ear darf ein Anbieter in Deutschland weder Batterien noch Elektro- und Elektronikgeräte in Verkehr bringen. Mit dem Wert "Nein" werden Artikel gekennzeichnet, die nicht betroffen sind. Mit dem Wert "Ja, unterliegt der Registrierungspflicht" werden Artikel gekennzeichnet, die der Registrierungspflicht gemäß Batteriegesetz (BattG) oder Elektro- und Elektronikgerätegesetz (ElektroG) unterliegen und ordnungsgemäß bei der stiftung ear registriert wurden.
-
Registrierungsnr. (BattG)/(ElektroG)
Registrierungsnummer der Stiftung elektro-altgeräte register (stiftung ear) gemäß Batteriegesetzt und Elektro- und Elektronikgerätegesetz.
Die Registrierungsnummer wird dem Hersteller/Bevollmächtigten durch die stiftung ear mit dem Registrierungsbescheid mitgeteilt. Die Registrierungsnummer ist ein achtstelliger numerischer Wert.
Sie wird in folgender Form von der stiftung ear vergeben:
WEEE-Reg.-Nr. DE xxxxxxxx, wobei x=0...9.
Der Zusatz DE zeigt dabei, dass der Hersteller/Bevollmächtigte in Deutschland registriert ist.
- securPharm-Pilot - Kennzeichen, dass Packungen am securPharm-Pilotbetrieb teilnehmen. Artikel, die am Pilotbetrieb teilnehmen und einen gültigen DataMatrix Code besitzen, werden immer verifiziert. Dies gilt auch über den Stichtag (Februar 2019) hinaus. Im Pilotbetrieb sind diese Packungen grundsätzlich abgabefähig.
-
Hochladedatum - "Verifizierung im Pflichtbetrieb ab Hochladedatum" Angegeben ist das Datum, ab dem individuelle Daten von Packungen abrufbar sind, die der Verifizierungspflicht im Pflichtbetrieb unterliegen. Die Belegung des Datums „Verifizierung im Pflichtbetrieb ab Hochladedatum“ ist für die Apotheke der verbindliche Hinweis für eine Verifikationspflicht. Relevant für securPharm.
- Verfalldatum Pflichtbetrieb - Gibt das Verfalldatum der ersten Charge im Pflichtbetrieb an, d.h. mit Erreichen dieses Datums ist der Artikel verifikationspflichtig. Bis zu diesem Datum ist der Artikel teilweise verifikationspflichtig, d.h. es sind Packungen mit securPharm-Code ( (ab dem 09.02.2019 in Umlauf gebracht) und ohne securPharm-Code (bis zum 09.02.2019 in Umlauf gebracht und noch nicht verfallen) im Umlauf.
"Verifizierung im Pflichtbetrieb ab Verfalldatum" Verfalldatum der Charge, ab der im Pflichtbetrieb verifiziert wird. Packungen mit einem Verfalldatum gleich oder größer als das hier angegebene Verfalldatum nehmen am Pflichtbetrieb der Verifizierung teil. Relevant für securPharm.