ABDA-Lagerinfo
Die Eingabefelder sind nur bei selbst angelegten Artikeln und vorerfassten ABDA-Artikeln eingabefähig.
Über die Auswahlleiste oben im Fenster können Sie zwischen den Artikeln der letzten Trefferliste wechseln. Die Daten des gewählten Artikels werden auf der Seite unten im Fenster angezeigt.
Von links nach rechts zeigt die Auswahlleiste folgende Informationen zum aktuellen Artikel:
-
Icon 'Vertriebsinformation'

Außer Vertrieb 
Rückruf 
zurückgezogen 
Nachfolgeartikel 
Vorgängerartikel 
Außer Vertrieb, gelöscht 
Rückruf', gelöscht 
zurückgezogen', gelöscht 
gelöschter (selbst angelegter) Artikel 
Außer Vertrieb' mit Nachfolger 
Außer Vertrieb' mit Vorgänger 
Außer Vertrieb', gelöscht mit Nachfolger 
Außer Vertrieb', gelöscht mit Vorgänger 
Rückruf' mit Nachfolger 
Rückruf' mit Vorgänger 
Rückruf', gelöscht mit Nachfolger 
Rückruf', gelöscht mit Vorgänger 
zurückgezogen' mit Nachfolger 
zurückgezogen' mit Vorgänger 
zurückgezogen', gelöscht mit Nachfolger 
zurückgezogen', gelöscht mit Vorgänger 
selbst angelegter Artikel mit Nachfolger 
selbst angelegter Artikel mit Vorgänger 
gelöschter (selbst angelegter Artikel mit Nachfolger 
gelöschter (selbst angelegter) Artikel mit Vorgänger. Mit Klick auf die (kombinierten) Vorgänger-/Nachfolgerbuttons öffnet sich die 'Artikelsuche mit Nachfolge- und Vorgängerartikel' 
Sonderartikel (Ärztemuster, Musterartikel) 
Rote-Hand-Brief (Anzeige nur während des Gültigkeitszeitraums bzw. bis zu 6 Monate nach Erscheinen) 
Rote-Hand-Brief, dessen Gültigkeitszeitraum abgelaufen ist bzw. der älter als 6 Monate ist 
Informationsbrief (Anzeige nur während des Gültigkeitszeitraums bzw. bis zu 6 Monate nach Erscheinen) 
Informationsbrief, dessen Gültigkeitszeitraum abgelaufen ist bzw. der älter als 6 Monate ist 
Schulungsmaterial Priorität der Anzeige:
-
Vertriebsfähigkeitsstatus
-
Rote-Hand-Brief
-
Informationsbrief
-
Schulungsmaterial
-
Vorgänger/Nachfolger
-
selbst angelegter Artikel
-
- Artikelbezeichnung und weitere Artikeldetails
-
Symbol 'Artikelinformation' ggf. kombiniert mit sonstigen Informationen

aktuelle Info (nicht länger als 6 Monate zurückliegend) 
eigene Info 
aktuelle und eigene Info 
aktuelle, eigene und sonstige Info 
eigene und sonstige Info 
sonstige Info: Teedrogen-, Produkt- und Anbieter-Informationen
- DAR - Darreichungsform-Kennzeichen.
- Einheit - Packungsgrößenangabe in Menge und Einheit.
-
NP - Normpackungsgröße. Folgende Angaben sind neben N1, N2 u. N3 möglich:
nb nicht betroffen - der Artikel ist nicht von der Packungsgrößenverordnung betroffen. nt nicht therapiegerecht - die Packungsgröße ist größer als die größte vorgegebene Messzahl. - PZN - Pharmazentralnummer.
- Status: Aktueller Lagerstatus des Artikels.
- Verfall: Zeigt das nächste Verfalldatum.
- Bestand: Aktueller Bestand des Artikels, berechnet über alle Bestände.
- Nachl.: Für offene Nachlieferungen benötigte Menge.
- Res.Mg: In offenen (nicht abgeschlossenen) Verkäufen reservierte Menge. Mehr dazu im Thema 'Temporäre Reservierung von Packungen in offenen Verkäufen'.
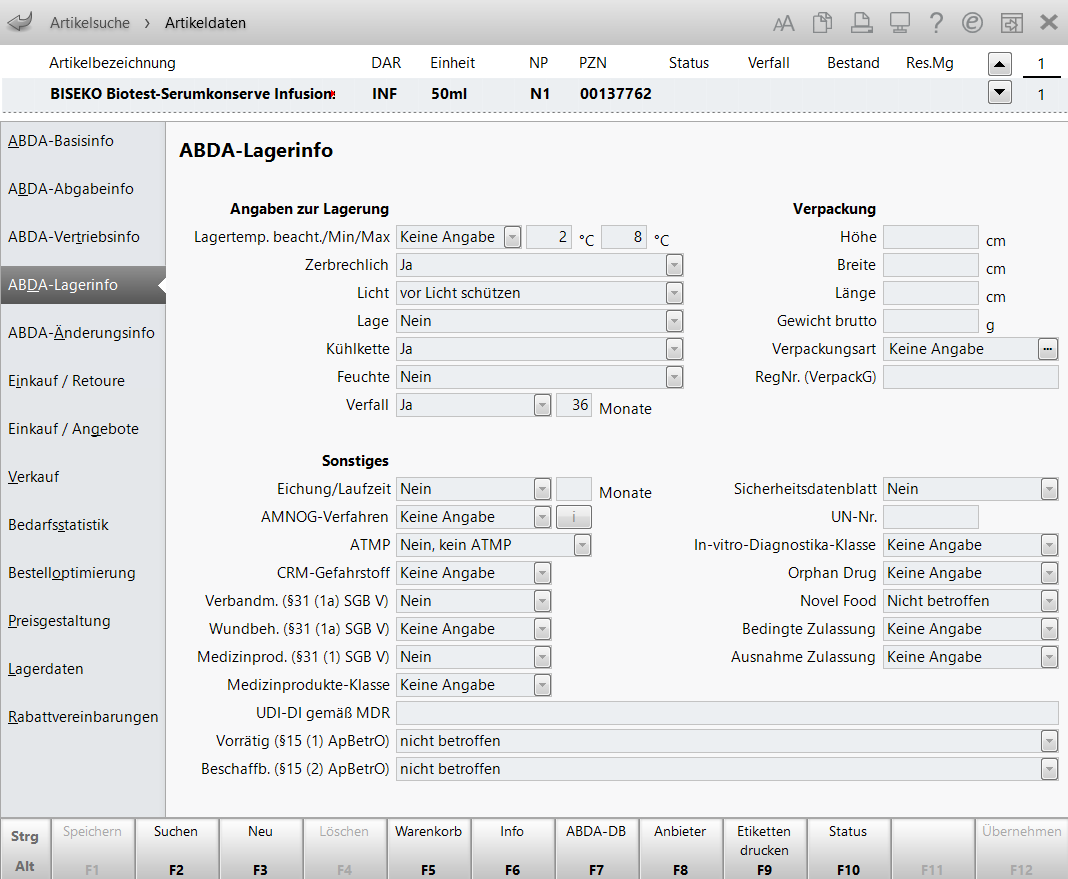
Angaben zur Lagerung
In diesem Bereich werden folgende Informationen angezeigt:
- Lagertemp. beachten/Min./Max.:
Der Wert im DropDown-Menü kennzeichnet, ob beim Artikel eine Lagertemperatur zu beachten ist.
Mögliche Werte sind 'Keine Angabe', 'Nein', 'Ja, med. Zw. (§ 2 Nr. 1)' und 'Ja, med.-wiss. Zw. (§ 2 Nr. 2)'. In den Feldern dahinter sind die minimale und die maximale Lagertemperatur für diesen Artikel angegeben.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
- Zerbrechlich:
Kennzeichnet, ob der Artikel zerbrechlich ist.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Licht:
Kennzeichnet die Lichtempfindlichkeit des Artikels.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Vor Licht schützen', 'Vor Sonne schützen'. - Lage:
Kennzeichnet die Lageempfindlichkeit des Artikels.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Liegend lagern', 'Aufrecht lagern'. - Kühlkette:
Kennzeichnet, ob es sich um einen temperaturempfindlichen Artikel handelt, der bei Lagerung und Transport gekühlt werden muss. Die Einstellung wird z.B. bei Bestellungen ausgewertet, um Kühlartikel besonders berücksichtigen zu können.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - Feuchte:
Kennzeichnet die Feuchtigkeitsempfindlichkeit des Artikels.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Trocken lagern'. - Verfall:
Kennzeichnet, ob ein Verfalldatum auf dem Artikel angegeben ist.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
Bei Einstellung 'Ja' können Sie im nebenstehenden Eingabefeld die garantierte Haltbarkeitsdauer in Monaten eintragen.
Verpackung
In diesem Bereich werden folgende Informationen angezeigt:
- Höhe, Breite Länge:
Diese Felder zeigen die Abmessungen der Verpackung in cm. - Gewicht brutto:
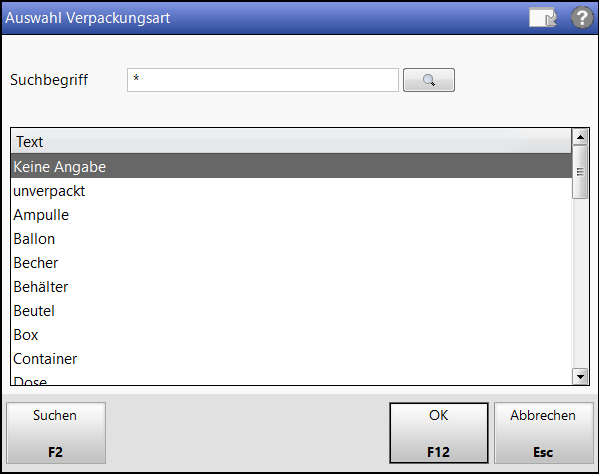
Gibt das Bruttogewicht des Artikels im Gramm an. - Verpackungsart:
Zeigt die Verpackungsart des Artikels an. Bei selbst angelegten Artikeln oder vorerfassten ABDA-Artikeln können Sie eine Verpackungsart einstellen. Klicken Sie auf den Browsebutton , um die gewünschte Verpackungsart auszuwählen.
, um die gewünschte Verpackungsart auszuwählen. - RegNr. (VerpackG)
Für Hersteller bzw. Erstinverkehrbringer von systembeteiligungspflichtigen/lizenzierungspflichtigen Verpackungen besteht durch das neue Verpackungsgesetz (VerpackG) ab 01.01.2019 die Pflicht zur Registrierung bei der Zentralen Stelle (§ 9 Abs. 1 VerpackG). Apotheken fallen grundsätzlich in den Anwendungsbereich des Verpackungsgesetzes, sofern sie systembeteiligungspflichtige Verpackungen in den Verkehr bringen. In der Regel sind dies Verkaufsverpackungen, also die Primärverpackungen von Arzneimitteln oder sonstigen Produkten, die in der Apotheke vertrieben werden. Apotheken gelten dabei nach § 3 Abs. 13 VerpackG als Vertreiber. Darüber hinaus sind sie regelmäßig auch Letztvertreiber im Sinne des § 3 Abs. 14 VerpackG.
Sonstiges
In diesem Bereich werden folgende Informationen angezeigt:
- EUDR/HS-Code:
EUDR kennzeichnet, ob der Artikel einer Warengruppe zugehört, die der Verordnung (EU) 2023/1115 (EUDR) unterliegt. Die EUDR (EU-Verordnung für entwaldungsfreie Produkte) ist eine EU-Verordnung, die sicherstellt, dass nur Produkte auf dem EU-Markt gehandelt werden, die nicht zu weltweiter Entwaldung und Waldschädigung beitragen.
Der HS-Code (=Harmoniertes System) wird von der Weltzollorganisation (WZO) erstellt und ist ein international standardisiertes System zur weltweit einheitlichen Klassifizierung von Waren. Die Kennzeichnung von Artikeln erfolgt im Zusammenhang mit der EUDR. - Eichung/Laufzeit:
Kennzeichen gemäß §2 Eichgesetz, ob eine Eichpflicht für diesen Artikel vorliegt.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'.
Besteht eine Eichpflicht, wird neben der Einstellung der Gültigkeitszeitraum der Eichung in Monaten (Eichlaufzeit) angegeben. - Sicherheitsdatenblatt:
Kennzeichnet, ob zum Artikel ein Sicherheitsdatenblatt (für Gefahrstoffe) erforderlich ist.
Mögliche Angaben sind 'Keine Angabe', 'Nein', 'Ja'. - AMNOG-Verfahren:
Kennzeichen, ob der Gemeinsame Bundesausschuss eine Nutzenbewertung gemäß § 35a SGB V durchgeführt oder bereits abgeschlossen hat. Zusätzlich liefert der G-BA ggf. Informationen zu diesem Verfahren in Form eines oder mehrerer Internet-Links (siehe auch Infofenster unten).Mögliche Werte im Feld "AMNOG-Verfahren" sind:
0 = Keine Angabe,
1 = Nein,
2 = Ja, im Verfahren (befindet sich im Nutzenbewertungsverfahren),
3 = Ja, abgeschlossen (Nutzenbewertungsverfahren abgeschlossen).
Die Information wird in Form eines Internet-Links ausgegeben. Dazu sehen Sie rechts neben den Werten das Info-Symbol mit zugehörigem Tooltipp. - UN-Nr.
Jedes Sicherheitsdatenblatt ist mit einer sog. UN-Nr. versehen. Die UN-Nr. beschreibt das Gut, von dem ein Gefährdungspotential ausgeht.

 Informationen zu Nutzenbewertung gemäß § 35a SGB V
Informationen zu Nutzenbewertung gemäß § 35a SGB V
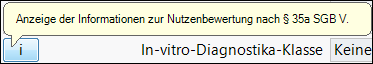
Anzeige: Das Info-Symbol ist aktiv und der Tooltipp lautet "Anzeige der Information zur Nutzenbewertung nach §35a SGB V".
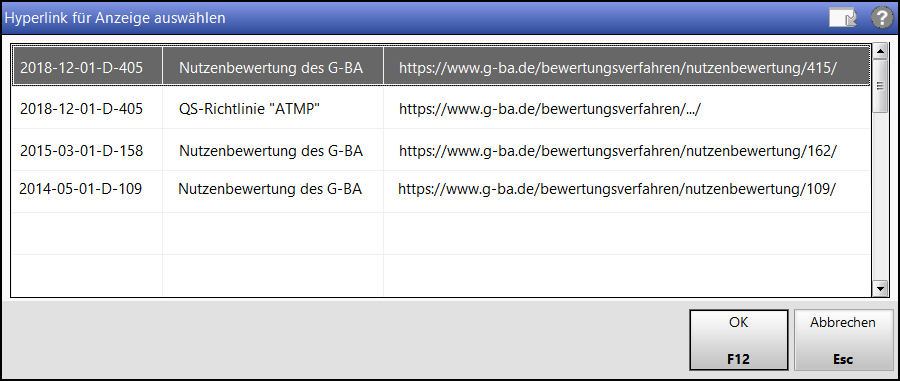
Klicken Sie auf das Info-Symbol. Gibt es nur einen Link, so öffnet sich Ihr Standardbrowserfenster mit der zugehörigen Information.
Gibt es mehrere Links zu Informationen, so erscheint ein
Klicken Sie auf den Link, um die entsprechende Information in Ihrem Browserfenster anzuzeigen.
Das Auswahlfenster schließen Sie mit OK - F12.
- ATMP
Kennzeichen, ob es sich um Arzneimittel für neuartige Therapien(ATMP – Advanced Therapy Medicinal Products) handelt und ggf. Art des ATMP
- In-vitro-Diagnostika-Klasse
Diese Kennzeichnung bildet die Einstufung von Produkten unter Berücksichtigung ihrer Zweckbestimmung und der damit verbundenen Risiken gemäß Artikel 47 Absatz 1 der Verordnung (EU) 2017/746 des Europäischen Parlaments und des Rates vom 5. April 2017 über In-vitro-Diagnostika in die Klassen A, B, C und D ab. Die Klassifizierung erfolgt gemäß Anhang VIII der genannten Verordnung.
- CRM-Gefahrstoff
Kennzeichen, ob der Artikel (auch Fertigarzneimittel) einen oder mehrere Inhaltsstoffe (auch Wirkstoffe) enthält, die einzeln oder in Kombination karzinogen, keimzellmutagen oder reproduktionstoxisch sind. - Orphan Drug
Kennzeichen für Arzneimittel zur Behandlung eines seltenen Leidens nach der Verordnung (EG) Nr. 141/2000 des Europäischen Parlaments und des Rates vom 16.12.1999 über Arzneimittel für seltene Leiden (ABI. L 18 vom 22.01.2000, S. 1) - Verbandm. (§31 (1a) SGB V)
Kennzeichen, ob es sich um ein Verbandmittel gemäß § 31 Abs. 1a SGB V handelt. Es handelt sich um eine vom Anbieter gemeldete Information. Unplausible Konstellationen zu den Informationen in der A+V Hilfsmittelvertragsdatenbank sind möglich.
-
Novel Food
Kennzeichen gemäß der Verordnung (EU) 2015/2283 über neuartige Lebensmittel (Novel-Food-Verordnung) -
Wundbeh. (§31 (1a) SGB V
Sonstiges Produkt zur Wundbehandlung nach §31 (1a) SGB V. - Bedingte Zulassung
Kennzeichen für Arzneimittel mit einer Genehmigung nach Artikel 14 Absatz 7 der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates vom 31.03.2004 zur Festlegung von Gemeinschaftsverfahren für die Genehmigung und Überwachung von Human- und Tierarzneimitteln und zur Errichtung einer europäischen Arzneimittel-Agentur (ABI. L 136 vom 30.04.2004, S. 1) (bedingte Zulassung) Arzneimittel mit bedingter Zulassung können noch vor Abschluss der vollständigen klinischen Prüfung auf den Markt gebracht werden. - Medizinprod. (§31 (1) SGB V)
Kennzeichen, ob es sich um ein Medizinprodukt gemäß § 31 Abs. 1 Satz 2 SGB V handelt. Es handelt sich um eine vom Anbieter gemeldete Information. Unplausible Konstellationen zu den Verordnungsvorgaben des Typs "Anl. V AM-RL (verordnungsfähige Medizinprodukte)" sind nicht auszuschließen.
- Ausnahme Zulassung
Kennzeichen für Arzneimittel mit einer Genehmigung nach Artikel 14 Absatz 8 der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates vom 31.03.2004 zur Festlegung von Gemeinschaftsverfahren für die Genehmigung und Überwachung von Human- und Tierarzneimitteln und zur Errichtung einer europäischen Arzneimittel-Agentur (ABI. L 136 vom 30.04.2004, S. 1) (Zulassung in Ausnahmefällen). - Medizinprodukte-Klasse
Dieses Kennzeichen bildet die Einstufung von Produkten gemäß Artikel 51 Absatz 1 der Verordnung (EU) 2017/745 unter Berücksichtigung ihrer Zweckbestimmung und der damit verbundenen Risiken in die Klassen I, IIa, IIb und III ab. Die Klassifizierung erfolgt gemäß Anhang VIII der genannten Verordnung.
-
UDI-DI gemäß MDR
Eindeutiger numerischer oder alphanumerischer Code, der im Zuge der MDR (VO (EU) 2017/745) sowie der IVDR (VO (EU) 2017/746 vom 05.04.2017) der Identifikation von Medizinprodukten auf Artikelebene dient. -
Vorrätig (§15 (1) ApBetrO):
Die einzelnen Werte fassen Gruppen von Arzneimitteln oder weiteren Produkten zusammen, aus denen Präparate gemäß § 15 (1) Satz 2 der Apothekenbetriebsordnung 2012 in der Apotheke vorrätig zu halten sind (Notfalldepot).
-
Beschaffb. (§15 (2) ApBetrO)
Mit einem Wert ungleich 'nicht betroffen' sind Artikel gekennzeichnet, die gemäß § 15 (2) der Apothekenbetriebsordnung entweder in der Apotheke vorrätig zu halten sind oder kurzfristig beschafft werden können.